2 × mélange PCR Taq Platinum
Définition de l'activité
1 unité (U) L'activité de l'ADN polymérase Taq Platinum est définie comme la quantité d'enzyme nécessaire pour incorporer 10 nmoles de désoxynucléotides dans des substances insolubles dans l'acide à 74 °C en 30 minutes en utilisant l'ADN de sperme de saumon activé comme matrice/amorce.
Contrôle de qualité
La pureté par détection SDS-PAGE est supérieure à 99% ; Aucune activité de nucléase exogène n'est détectée ; Un gène à copie unique dans le génome humain pourrait être amplifié efficacement ; Aucun changement d'activité significatif lorsqu'il est conservé à température ambiante pendant une semaine.
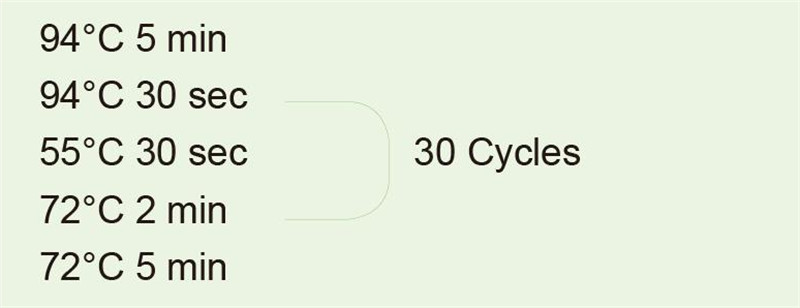
Paramètres techniques principaux
Il a une activité exonucléase 5'-3' et une activité exonucléase 3'-5', et sa fidélité est proche de la polymérase Pfu. La vitesse d'extension de la Taq Platinum Polymerase est plus rapide que la Pfu polymérase et l'efficacité d'amplification est plus élevée. Les produits de PCR peuvent être directement ligaturés à l'extrémité franche ou clonés avec le vecteur TA. Si l'efficacité du clonage doit être améliorée, il est recommandé de purifier d'abord et d'ajouter des surplombs de 3'-dA avant le clonage dans le vecteur TA.
Un tube Taq Platinum MasterMix (Certification nationale des produits de haute technologie)
■ Le Taq Platinum MasterMix a amélioré la spécificité et la sensibilité de la réaction PCR et peut amplifier des matrices complexes avec une teneur élevée en GC, une structure secondaire, etc. Aussi peu que 2 copies du modèle cible peuvent être amplifiées, garantissant des résultats expérimentaux plus précis.
■ La formule unique de Taq Platinum MasterMix rend l'ensemble du système de réaction très stable et l'activité ne sera pas affectée par des gels-dégels répétés ou un stockage à long terme à 4°C.
■ La solution mixte PCR pré-préparée stable et efficace peut rendre l'opération rapide et simple, réduisant considérablement l'intensité du travail et l'erreur d'échantillonnage. Un activateur et un optimiseur de PCR hautes performances sont également inclus dans le mélange, ce qui réduit les exigences relatives aux conditions de PCR.
■ Ce produit possède à la fois des systèmes contenant et sans colorant. Les produits MasterMix contenant des colorants peuvent être directement soumis à une électrophorèse après PCR, sans ajouter de tampon de chargement.
Applications
Il peut remplacer la polymérase Pfu pour amplifier des produits haute fidélité à partir de modèles complexes tels que les génomes, et il convient à des applications telles que le clonage de gènes d'expression, les mutations spécifiques à un site et l'analyse du polymorphisme nucléotidique unique (SNP), etc.
Précautions lors de la conception des amorces PCR :
La longueur de l'amorce est généralement de 20-25 mer. Cependant, lors de la réalisation d'une PCR à long fragment, la longueur de l'amorce doit être augmentée à 30-35 mer.
■ Il n'y a pas d'appariement complémentaire entre les deux amorces, notamment pour les 3 dernières bases à l'extrémité 3'.
■ La teneur en GC doit être de 50 à 60 % et éviter les GC ou AT riches locaux. Afin que l'amorce et la matrice se lient de manière stable, évitez la structure riche en AT à l'extrémité 3'.
■ Éviter l'apprêt pour former une structure secondaire.
■ Sélectionnez deux amorces avec des températures Tm proches l'une de l'autre.
Calcul de la valeur Tm des amorces pour la PCR :
■ Lorsque le primaire est inférieur à 20 mer : Tm=2°C×(A+T)+4°C×(G+C).
■ Lorsque l'amorce est supérieure à 20 mer : Tm=81,5+0,41×(GC%)-600/L, où L est la longueur de l'amorce.
■ Régler la température de recuit à (Tm-5)°C.
Entrée d'amorce PCR
La concentration finale appropriée des amorces peut être choisie entre 0,1 µM et 1,0 µM. Une concentration d'amorce trop faible conduit à un faible rendement en produits d'amplification, tandis qu'une concentration d'amorce trop élevée est plus sujette à une amplification non spécifique. Habituellement, lorsque la quantité d'ADN matrice est importante ou que l'ADN matrice complexe (tel que l'ADN du génome humain) est utilisé comme matrice, la concentration en amorce doit être plus faible. Lorsque la quantité d'ADN matrice est petite ou que l'ADN matrice simple (par exemple, l'ADN plasmidique, etc.) est utilisé comme matrice, la concentration en amorce doit être plus élevée.
Tous les produits peuvent être personnalisés pour ODM/OEM. Pour plus de détails,s'il vous plaît cliquez sur Service personnalisé (ODM/OEM)
  |
Utilisez l'ADN génomique comme modèle pour amplifier le fragment de 1 kb. Après la réaction PCR, prenez 5 ul pour la détection par électrophorèse. |
Modèle A-1
■ La matrice contient des impuretés protéiques ou des inhibiteurs de Taq, etc. ——Purifiez la matrice d'ADN, éliminez les impuretés protéiques ou extrayez l'ADN matrice avec des kits de purification.
■ La dénaturation de la matrice n'est pas complète ——Augmentez de manière appropriée la température de dénaturation et prolongez le temps de dénaturation.
■ Dégradation du modèle ——Repréparez le modèle.
A-2 Apprêt
■ Mauvaise qualité des amorces —— Re-synthétiser l'amorce.
■ Dégradation des amorces ——Aliquoter les amorces à haute concentration dans un petit volume pour la conservation. Éviter les congélations et décongélations multiples ou la cryoconservation à 4°C à long terme.
■ Conception incorrecte des amorces (par exemple, longueur d'amorce insuffisante, dimère formé entre les amorces, etc.) -Reconception des amorces (éviter la formation de dimère d'amorce et de structure secondaire)
A-3 mg2+concentration
■ mg2+ la concentration est trop faible ——Augmentez correctement Mg2+ concentration : Optimiser le Mg2+ concentration par une série de réactions de 1 mM à 3 mM avec un intervalle de 0,5 mM pour déterminer le Mg optimal2+ concentration pour chaque matrice et amorce.
A-4 Température de recuit
■ La température de recuit élevée affecte la liaison de l'amorce et de la matrice. ——Réduire la température de recuit et optimiser la condition avec un gradient de 2°C.
A-5 Temps de prolongation
■ Durée d'extension courte——Augmente la durée d'extension.
Phénomènes : Les échantillons négatifs montrent également les bandes de séquence cible.
A-1 Contamination de la PCR
■ Contamination croisée de la séquence cible ou des produits d'amplification —— Veillez à ne pas pipeter l'échantillon contenant la séquence cible dans l'échantillon négatif ou à ne pas les renverser hors du tube de centrifugation. Les réactifs ou l'équipement doivent être autoclavés pour éliminer les acides nucléiques existants, et l'existence d'une contamination doit être déterminée par des expériences de contrôle négatif.
■ Contamination des réactifs ——Aliquoter les réactifs et conserver à basse température.
A-2 Premierr
■ mg2+ la concentration est trop faible ——Augmentez correctement Mg2+ concentration : Optimiser le Mg2+ concentration par une série de réactions de 1 mM à 3 mM avec un intervalle de 0,5 mM pour déterminer le Mg optimal2+ concentration pour chaque matrice et amorce.
■ Conception d'amorce incorrecte et la séquence cible présente une homologie avec la séquence non cible. —— Re-conception des amorces.
Phénomènes : Les bandes d'amplification PCR ne correspondent pas à la taille attendue, qu'elles soient grandes ou petites, ou parfois des bandes d'amplification spécifiques et des bandes d'amplification non spécifiques se produisent.
A-1 Apprêt
■ Mauvaise spécificité d'amorce
——Amorce de refonte.
■ La concentration d'amorce est trop élevée ——Augmentez correctement la température de dénaturation et prolongez le temps de dénaturation.
A-2 mg2+ concentration
■ Le magnésium2+ la concentration est trop élevée ——Réduire correctement la concentration de Mg2+ : Optimiser la concentration de Mg2+ concentration par une série de réactions de 1 mM à 3 mM avec un intervalle de 0,5 mM pour déterminer le Mg optimal2+ concentration pour chaque matrice et amorce.
A-3 Polymérase thermostable
■ Quantité d'enzyme excessive ——Réduire la quantité d'enzyme de manière appropriée à des intervalles de 0,5 U.
A-4 Température de recuit
■ La température de recuit est trop basse ——Augmentez la température de recuit de manière appropriée ou adoptez la méthode de recuit en deux étapes
Cycles de PCR A-5
■ Trop de cycles PCR ——Réduisez le nombre de cycles PCR.
A-1 Apprêt——Mauvaise spécificité ——Re-concevoir l'amorce, changer la position et la longueur de l'amorce pour améliorer sa spécificité; ou effectuer une PCR nichée.
A-2 ADN modèle
——La matrice n'est pas pure ——Purifiez la matrice ou extrayez l'ADN avec des kits de purification.
A-3 mg2+ concentration
——Mg2+ la concentration est trop élevée ——Réduire correctement le Mg2+ concentration : Optimiser le Mg2+ concentration par une série de réactions de 1 mM à 3 mM avec un intervalle de 0,5 mM pour déterminer le Mg optimal2+ concentration pour chaque matrice et amorce.
A-4 dNTP
——La concentration de dNTP est trop élevée ——Réduire la concentration de dNTP de manière appropriée
A-5 Température de recuit
——Température de recuit trop basse ——Augmenter la température de recuit de manière appropriée
A-6 Cycles
——Trop de cycles ——Optimiser le nombre de cycles

La première étape consiste à choisir la polymérase appropriée. La polymérase Taq régulière ne peut pas relire en raison du manque d'activité de l'exonucléase 3'-5', et le mésappariement réduira considérablement l'efficacité d'extension des fragments. Par conséquent, la polymérase Taq normale ne peut pas amplifier efficacement les fragments cibles de plus de 5 kb. La polymérase Taq avec une modification spéciale ou une autre polymérase haute fidélité doit être sélectionnée pour améliorer l'efficacité d'extension et répondre aux besoins d'amplification de fragments longs. De plus, l'amplification de longs fragments nécessite également un ajustement correspondant de la conception de l'amorce, du temps de dénaturation, du temps d'extension, du pH du tampon, etc. Habituellement, les amorces avec 18-24 pb peuvent conduire à un meilleur rendement. Afin d'éviter d'endommager la matrice, le temps de dénaturation à 94°C doit être réduit à 30 secondes ou moins par cycle, et le temps d'élévation de la température à 94°C avant l'amplification doit être inférieur à 1 min. De plus, le réglage de la température d'extension à environ 68°C et la conception du temps d'extension en fonction de la vitesse de 1 kb/min peuvent garantir une amplification efficace de longs fragments.
Le taux d'erreur de l'amplification PCR peut être réduit en utilisant diverses ADN polymérases avec une haute fidélité. Parmi toutes les ADN polymérases Taq trouvées jusqu'à présent, l'enzyme Pfu a le taux d'erreur le plus bas et la fidélité la plus élevée (voir tableau ci-joint). En plus de la sélection d'enzymes, les chercheurs peuvent réduire davantage le taux de mutation PCR en optimisant les conditions de réaction, notamment en optimisant la composition du tampon, la concentration de polymérase thermostable et en optimisant le nombre de cycles de PCR.
Catégories de produits
POURQUOI NOUS CHOISIR
Depuis sa création, notre usine a développé des produits de première classe mondiale en respectant le principe
de qualité d'abord. Nos produits ont acquis une excellente réputation dans l'industrie et une grande confiance parmi les nouveaux et les anciens clients.








